Os ajustes nas etapas de processamento diferenciarão os diferentes tipos de queijos, que podem ser classificados em relação ao processamento e atributos
O queijo é um derivado do leite amado por muitas pessoas em todo mundo! Existem diversos tipos de queijos, entretanto, podemos defini-lo brevemente como um produto lácteo obtido por separação parcial do soro do leite por coagulação enzimática ou ácida das proteínas presentes no leite, promovendo a agregação das caseínas.
Além disso, também existe o queijo, conhecido como ricota, obtido pela adição de ácido e aplicação de energia na forma de calor ao soro do leite, promovendo a desnaturação e precipitação das proteínas. (Instrução Normativa nº 65, de 21 de julho de 2020).
Neste artigo, abordaremos a riqueza da conversão do leite em queijo, do ponto de vista físico-químico. Afinal, o que ocorre no leite (ou no soro, no caso da ricota) para que ele se transforme de um produto líquido em um produto sólido (ou pastoso) rico em proteínas e outros nutrientes?
A agregação das proteínas
O leite possui dois grupos principais de proteínas: as caseínas (cerca de 80% do conteúdo proteico do leite) e as proteínas do soro (~ 20%). A maioria dos queijos, como o queijo Minas Padrão, o Minas Frescal, o Prato, o Cottage e o requeijão são produzidos por meio da agregação das micelas de caseína. Um pequeno grupo de queijos são produzidos pela coagulação das proteínas do soro, cujo principal representante é a Ricota.
Como as proteínas do leite (caseínas e proteínas do soro) possuem excesso de cargas negativas no pH do leite, alterações na superfície das micelas de caseína (provocadas pela adição de ácido ou de enzimas coagulantes) e a desnaturação das proteínas do soro levará a coagulação destas proteínas. Este é o início da fabricação dos queijos!
A pergunta que não quer calar: afinal, como o leite se transforma em queijo?
De forma geral, são necessários quatro estágios para que o queijo seja obtido a partir do leite:
Modulações tecnológicas nesses estágios permitem a obtenção de uma grande variedade de queijos.
Coagulação do leite
A coagulação do leite pode acontecer de duas formas:
- Por proteólise (coagulação enzimática)
- Por acidificação (coagulação ácida).
Coagulação enzimática do leite
Na coagulação enzimática, as micelas de caseína são coaguladas por meio da ação do coalho, cuja principal enzima é a quimosina. Esse tipo de coagulação pode ser dividido em duas fases: (1) hidrólise da proteína estabilizadora da micela de caseína, a kappa-caseína (κ-cas), e (2) agregação e gelificação das micelas modificadas pelo coalho (Fox et al., 2017).
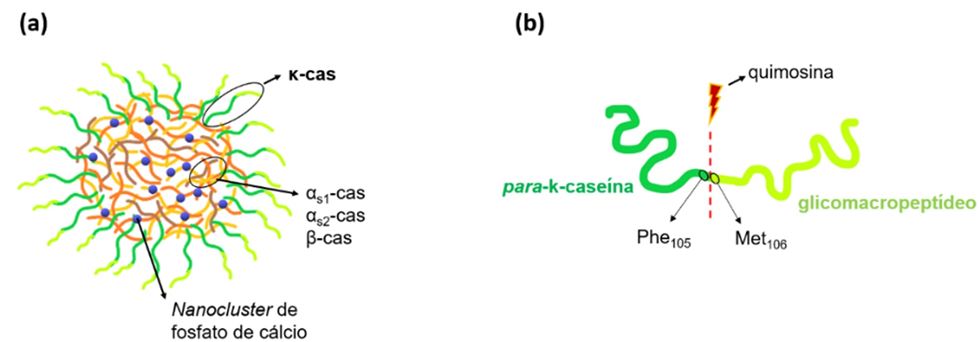
As moléculas de κ-cas formam a camada superficial da micela de caseína (Figura 1a), estabilizando esta partícula. Essa caseína possui grande sensibilidade à quimosina e é, portanto, hidrolisada quando se adiciona o coalho ao leite. Essa hidrólise ocorre especificamente na ligação entre os aminoácidos fenilalanina na posição 105 (Phe105) e metionina na posição 106 (Met106) (Figura 1b).
Figura 1. Representações esquemáticas de: (a) uma micela de caseína com seus constituintes, e (b) uma molécula de κ-cas e a indicação de hidrólise entre seus resíduos de aminoácidos Phe105 e Met106 pela quimosina.
Fonte: autoras.
Após a hidrólise da κ-caseína, a região N-terminal da molécula, chamada de para-κ-caseína (Figura 1b) se mantém ligada à micela, enquanto a região C-terminal, ou o glicomacropeptídeo (também conhecido como caseinomacropeptídeo) é liberado no soro.
Esse peptídeo liberado da micela é hidrofílico e altamente carregado eletrostaticamente, o que conferia estabilidade às micelas por repulsão eletrostática, impedindo que se agregassem. Além disso, esse peptídeo se projetava na superfície da micela e contribuía também com a estabilidade coloidal destas por meio de repulsão estérica.
- Projeto que isenta IPI na compra de carros por produtor tem parecer favorável
- Conab prevê recorde na produção de açúcar mesmo com redução na safra de cana
- Raça equina mais antiga do mundo é um dos destaques da ‘Expoagro’
- De neblina a tempestades: Previsão do clima para amanhã
- Os campeões de adaptação, saiba tudo sobre os caprinos da raça Boer
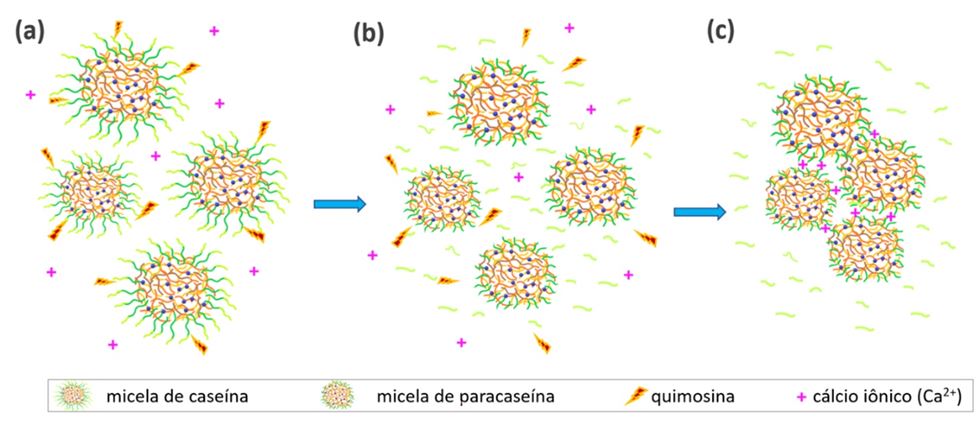
Dessa forma,após a hidrólise da κ-cas, o potencial zeta das micelas é reduzido de 2 a 3 vezes (redução da repulsão eletrostática entre as micelas) e a repulsão estérica também é reduzida. Como consequência, quando cerca de 85% do total de κ-cas é hidrolisada, dá-se início à segunda fase da coagulação enzimática: a redução da estabilidade das micelas (agora chamadas de “paracaseína”) a tal ponto que, quando se colidem, constroem uma rede tridimensional de micelas mediada pela interação entre cálcio iônico (Ca2+) presente no meio e grupos fosfosserílicos das caseínas (Fox et al., 2017). Eis, enfim, a formação do coágulo!
Além da rede de micelas de paracaseína, o coágulo (também chamado de paracaseinato de cálcio) é constituído por glóbulos de gordura e certa quantidade de soro. A coagulação enzimática do leite está resumida, esquematicamente, na Figura 2.
Figura 2. Representação esquemática da coagulação enzimática do leite: (a) micelas de caseína com moléculas de κ-cas sendo hidrolisadas por quimosina; (b) micelas de paracaseína (sem a camada intacta de κ-cas) e glicomacropeptídeos liberados para a fase contínua (soro); (c) agregação das micelas e formação do coágulo.
Fonte: adaptado de Fox et al. (2017).
Queijos produzidos por coagulação enzimática do leite representam cerca de 75% do total de queijos produzidos no mundo (Fox et al., 2017). Exemplos incluem Muçarela, Prato, Minas Frescal, Emental, Gorgonzola, Camembert, Provolone, entre outros.
Coagulação ácida do leite
Outro tipo de coagulação do leite, a coagulação ácida, caracteriza-se pela coagulação das micelas de caseína por meio da acidificação do leite até o ponto isoelétrico da caseína, que é em pH = 4,6. Essa acidificação do leite ocorre pela adição de culturas starter, que fermentam a lactose e produzem ácido lático, ou pela adição direta de ácido de grau alimentício, como o ácido lático.
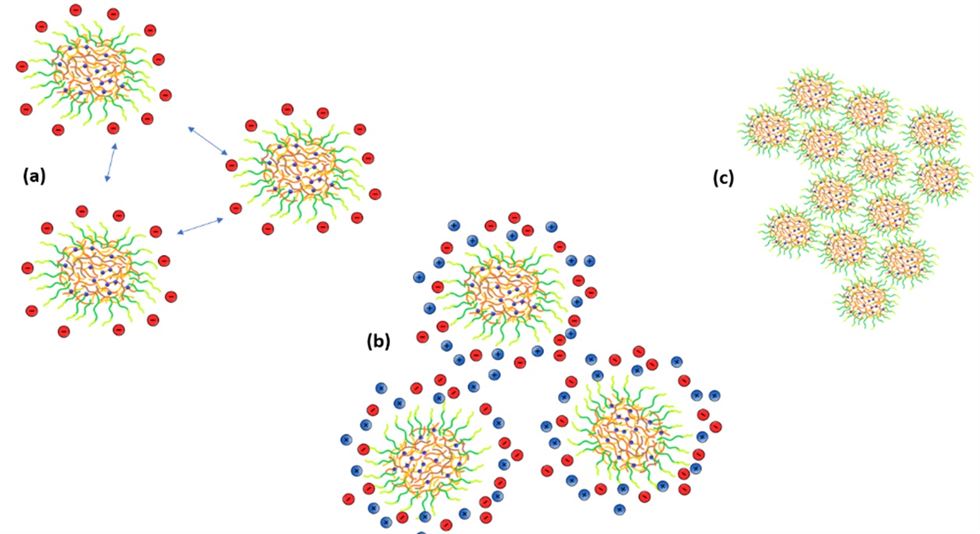
No pH do leite (pH = 6,6), as micelas de caseína encontram-se com carga elétrica líquida negativa (Figura 3a). Com a presença de ácido no leite, a simetria de cargas elétricas na superfície das micelas de caseínas é reduzida (Figura 3b).
Como consequência, as forças repulsivas entre as micelas diminuem e, à medida que o pH diminui em direção ao ponto isoelétrico da caseína, as micelas se agregam formando uma rede de caseína induzida por acidificação, o gel (Figura 3c) (Fox, 2012).
O gel resultante é formado por agregados hidratados, porosos e relativamente soltos de micelas de caseína, que são “mais fracos” que os agregados formados por coagulação enzimática. Exemplos de queijos de coagulação ácida incluem o Cottage, o Petit-Suisse e o requeijão.
Figura 3. Ilustração esquemática de: (a) micelas de caseína carregadas negativamente e com repulsão eletrostática entre elas (setas azuis); (b) redução da simetria de cargas na superfície das micelas devido à acidificação, representada pelos sinais positivos em azul, e (c) agregação de micelas de caseína (formação do gel).
Fonte: autoras.
Os géis obtidos tanto por coagulação enzimática quanto ácida são estáveis cineticamente se não sofrerem nenhuma perturbação, mas ao quebrá-los, a rede de caseínas se contrai e expulsa a fase aquosa do gel, o soro.
Este processo, conhecido como dessoragem, permite o controle do teor de umidade e, consequentemente, de parâmetros microbiológicos e bioquímicos do queijo. Após a dessoragem, o queijo, dependendo de sua variedade, é salgado com a finalidade de aumentar sua preservação e melhorar propriedades sensoriais.
Os queijos de coagulação ácida são conhecidos como queijos frescos e são consumidos sem passarem pela etapa de maturação. Apesar de também poderem ser consumidos ao final da fabricação, a maioria dos queijos de coagulação enzimática são maturados por períodos que podem variar de 3 semanas a mais de 2 anos. De forma geral, a duração da maturação é inversamente relacionada ao teor de umidade da variedade do queijo (Khattab et al., 2019).
Como transformar o soro em ricota?
A ricota é um queijo de origem italiana obtido por meio da coagulação e desnaturação das proteínas presentes no soro de leite (majoritariamente β-lactoglobulina e α-lactoalbumina), pela adição de ácido cítrico (0,11 g.L-1) e aquecimento (90ºC) (Rubel et. al., 2019). A agregação das proteínas do soro ocorre por meio das ligações por pontes dissulfeto, e formam uma estrutura em gel por meio de interações hidrofóbicas.
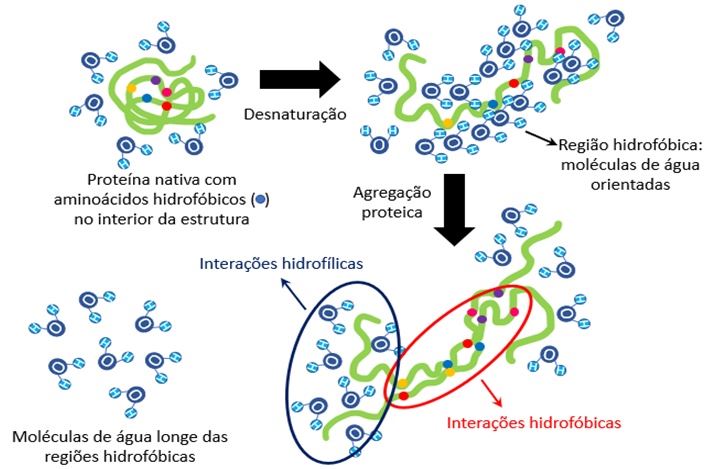
As proteínas do soro são proteínas globulares, estando presente em maior proporção na sua forma nativa no soro do leite obtido durante o processamento dos queijos de coagulação enzimática. Desta forma, é possível imaginar que, como a maior parte do soro é constituída por água, os resíduos de aminoácidos hidrofóbicos presentes nas proteínas no soro estão voltados para o interior da estrutura, enquanto os hidrofílicos situam-se na superfície. Quando ocorre a desnaturação, os aminoácidos hidrofóbicos são expostos (forçando a orientação das moléculas de água, o que não é favorável energeticamente).
Desta forma, visando minimizar a energia livre de Gibbs do sistema, estes aminoácidos hidrofóbicos interagem, liberando as moléculas de água, que passam a ter alto grau de liberdade. Estas interações, que são dirigidas predominantemente pelo aumento da entropia do sistema, dão origem aos coágulos de proteínas de soro, que resultam na ricota! Veja a representação esquemática na Figura 4.
Figura 4. Representação esquemática da desnaturação proteica, com consequente exposição de aminoácidos hidrofóbicos (representados pelas bolinhas coloridas). Seguindo, ocorre a agregação proteica, principalmente via interações hidrofóbicas e liberação das moléculas de água das regiões hidrofóbicas.
Fonte: autoras.
Estas interações são favorecidas pelo aumento da temperatura durante o processamento do queijo, e prevalecem sobre a repulsão eletrostática. As interações entres as proteínas são determinadas de acordo com a carga residual na superfície proteica, que são dependentes da força iônica, pH e presença de cálcio (Lucey, Johnson; Horne, 2003).